是否还记得小西家推出的护肤成分大咖"甘油葡萄糖苷 -- 你值得拥有",参与这位"大咖甘油葡萄糖苷"合成的重要糖苷水解酶 -- 蔗糖磷酸化酶,也是生来自带光芒。
蔗糖磷酸化酶可以将葡萄糖基转移至不同的受体合成熊果苷、甘油葡萄糖苷、低聚糖及多酚化合物的衍生物等产物[1],仅从参与这几种"重量大咖级"的产品合成反应可知蔗糖磷酸化酶生来不凡。
糖基化作用能赋予天然产物结构多样性,改善化合物水溶性、稳定性、生物利用度等性质,所得产物能广泛应用于食品、医药及个人护理等领域[2]。目前有机小分子化合物的糖基化方法包括化学法和生物酶法。但化学法存在许多缺点,如需要昂贵的或有毒的催化剂、副产物多、收率低、合成步骤复杂[3-4]等。而生物酶法反应条件温和,高效、绿色,反应产生的废料比化学法低5倍,时空产量高15倍[5]。这种利用酶催化合成糖苷类化合物的方法目前很受欢迎。
目前应用的糖基化反应生物酶有两种糖基转移酶类(Glycosyltransferases,GTs)和糖苷水解酶类(Glycoside hydrolases,GHs)[6],相比于糖基转移酶类,糖苷水解酶类在大规模催化中具有来源丰富、成本低的优势。蔗糖磷酸化酶(SPase)是GHs众多出色的葡萄糖基转移酶之一,SPase因其卓越的糖基化活性和广泛的受体底物特异性,能将Suc的葡萄糖基转移至多种受体化合物,使得SPase在糖基化应用中比同类成员葡聚糖蔗糖酶和淀粉蔗糖酶表现更为突出,尤其是对非碳水化合物的糖基化活性使其逐渐成为酶工程研究的热点[7]。
蔗糖磷酸化酶首次由Kagan等[8]在肠膜明串珠菌中发现,随后在多种微生物中发现。SPase主要分布在细菌中,在植物细胞中仅有少量分布。
目前报道的SPase的来源菌株主要有四种[9]:肠膜明串珠菌(Leuconostoc mesenteroides)[10]、变异链球菌(Streptococcus mutans)、双歧杆菌(Bifidobacterium sp.)、嗜糖假单胞菌(Pseudomonas saccharophila)
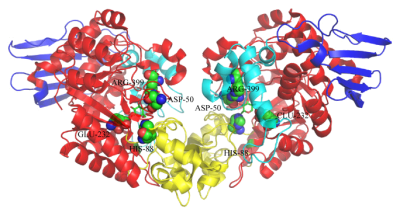
蔗糖磷酸化酶约有500个氨基酸,分子量在50-60 kD之间。不同来源的SPase有其独特的蛋白结构和底物特异性,来源于肠膜明串珠菌和变形链球菌的蔗糖磷酸化酶(LmSP、SmSP),是一种单体蛋白,而来自青春双歧杆菌和嗜糖假单胞菌的SPase是一类二聚体。2004年,来源于青春双歧杆菌(Bifidobacterium adolescentis)的蔗糖磷酸化酶(BaSP)的晶体结构(PDB 2gdv)被首次解析。如图 1所示,BaSP的晶体结构由4部分组成:结构域A、B、B'、C。结构域A包含一个GH13家族所共有的结构 -- (β/α) 8 桶,以及酶的活性位点;结构域B由2个反向平行的β-折叠和2个短的α-螺旋组成;结构域B'包括一长一短α-螺旋,其拓扑结构减小了底物通道的大小,不利于低聚糖的结合;结构域C由一个5链反向平行的β-折叠组成,虽然所有GH13家族的酶都含有此结构域,但仅在蔗糖磷酸化酶中存在折叠结构[1]。
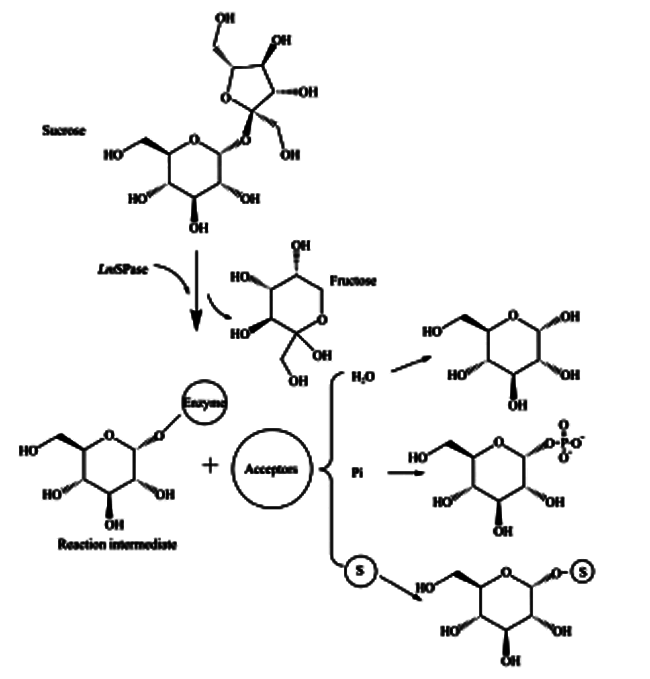
蔗糖磷酸化酶与GH13家族的其他酶一样,在反应时遵循双重置换机制。2个羧基氨基酸(在BaSP中为Asp192和Glu232,对应于LmSP中的Asp196和Glu237)在双重置换机制中起着关键作用,而且这2个催化残基完全保守。Asp192 (催化亲核试剂)攻击异头碳,同时Glu232 (一般酸/碱催化剂)将糖苷键的氧质子化,随后形成共价糖基酶中间体和释放果糖。如图 2所示,在受体位点发生构象变化后,中间体可与不同的受体底物(水、无机磷酸、糖等)反应,释放出糖苷产物。值得注意地是,水解作为副反应总是存在[1]。
近年来研究者利用酶的晶体结构和定点突变等方法详细阐释了酶的反应机制[11],利用相关位点定点突变研究证实了SPase的活性中心是结构域A中的催化三联体结构(Asp192:催化亲核试剂;Asp290:过渡态稳定剂、Glu232:酸/碱催化剂) (图3),其在序列和结构上都具有保守性[12-14]。

SPase是一种很有潜力的酶,主要用于合成低聚糖和糖苷类产物,具有很大的商业价值[1]。
低聚糖是一种新型功能型糖原,广泛应用于食品、保健品、医药和饲料添加剂等领域,具有多种功能生物学活性。目前,用于低聚糖合成的磷酸化酶主要有3类:蔗糖磷酸化酶、麦芽糖磷酸化酶和纤维二糖磷酸化酶,均属葡萄糖基转移酶。用于合成低聚糖的原料,如淀粉类、蔗糖、乳糖等,来源丰富且价格低廉。
曲二糖具有益生元及抑制α-葡萄糖苷酶的活性等作用,其可以通过SPase催化,以廉价的葡萄糖和蔗糖为底物合成,具有广泛的应用前景[15]。SPase可以催化蔗糖和D-半乳糖合成蜜二糖,而蜜二糖可作为合成更高聚合度的糖的前体并对减轻过敏性皮炎症状有益[16]。
此外,蔗糖磷酸化酶与其他酶一起反应也可以生成低聚糖。将来自Bifidobacterium longum的蔗糖磷酸化酶(BlSP)、来自Cellulomonas uda的纤维二糖磷酸化酶(CuCbP)及来自Clostridium cellulosi的纤维糊精磷酸化酶(CcCdP)混合,以蔗糖和葡萄糖为底物,可以合成短链纤维低聚糖[17]。一锅多酶系统的开发,实现了在一个罐中进行复杂的多步化学转化,可以合成低聚糖、多糖和糖缀合物等;而且无需分离反应中间体,简化了下游分离的步骤,在工业应用上引起了极大的关注[18-19]。
熊果苷是一种有效的皮肤美白剂,广泛应用于化妆品行业[20]。此外,熊果苷还具有抗氧化、抗菌活性及利尿特性,如今已用于治疗炎症、糖尿病、肾结石等病症[21-22]。熊果苷可分为α-熊果苷和β-熊果苷2类,在美白效果、水溶性和稳定性方面α-熊果苷要优于β-熊果苷[23],因此合成α-熊果苷越来越受到人们的关注。
目前,α-熊果苷的合成主要有3种方式,即化学合成、酶法合成及微生物合成。酶催化转糖基化反应是当前生产熊果苷的主要方式,表1列出了用于生产熊果苷的几种酶的相关信息,可以看出利用蔗糖磷酸化酶合成的产量明显增加。
|
酶
Enzymes
|
反应条件
Reaction conditions
|
产量
Yield
|
参考文献
References
|
| LmSP | 40 g/L hydroquinone, sucrose: hydroquinone=5:1, pH 7.0, 30 ℃, 24 h | 98.00 g/L | [24] |
| SmSPI336L | Whole cell transformation | 110.30 g/L | [25] |
| Amylosucrase | 20 mmol/L sucrose, 5 mmol/L hydroquinone, pH 7.0, 40 ℃ | 44.70% | [26] |
| XcAS | 1 mol/L sucrose, 200 mmol/L hydroquinone | 53.86 g/L | [27] |
| Dextransucrase | 215 mmol/L sucrose, 450 mmol/L hydroquinone | 544.00 mg/L | [28] |
GG在化妆品、食品等商业上的广泛应用,促进了其合成方法的发展。GG可分为1-甘油葡萄糖苷和2-甘油葡萄糖苷,其中2-甘油葡萄糖苷又称为αGG[29]。由于αGG的保湿效果优于1-甘油葡萄糖苷,因此目前的研究主要集中于合成αGG。早期报道过利用化学法合成αGG,但由于化学法合成效率低、提取复杂、生物合成法成本高,因此酶法合成是目前最常用的方法[30]。酶法合成αGG如表 2所示,均由蔗糖磷酸化酶参与合成。
|
酶
Enzymes
|
反应条件
Reaction conditions
|
产量
Yield
|
参考文献
References
|
| LmSP |
0.8 mol/L sucrose, 2.0 mol/L glycerol, 20 U/mL
SPase, pH 7.0, 30 ℃
|
63.0% | [31] |
| LmSP | Immobilized Z basic2 -SPase | 85.0% | [32] |
| LmSP | Whole-cell catalyst, 1 mol/L sucrose, 2.5 mol/L glycerol, pH 7.0, 30 ℃ | 189.3 g/L | [33] |
| BaSP/L341W | 200 g/L sucrose, 200 g/L glycerol, 30 ℃ | 86.0 g/L | [29] |
L-抗坏血酸(L-Ascorbic Acid,L-AA),又称维生素C,具有抗氧化、抗自由基、抑制酪氨酸酶的形成等功能,从而达到美白、淡斑的效果,可作为化妆品的有效成分。然而由于L-AA的高抗氧化活性,其在自然状态下不稳定,限制了L-AA在化妆品和食品工业的广泛应用[35]。利用来自Bifidobacterium longum的SPase (BlSP)催化蔗糖和L-AA合成L-抗坏血酸2-O-α-D-葡萄糖苷(L-Ascorbic Acid 2-Glucoside,AA-2G),该化合物是L-AA的稳定形式[36]。
曲酸(5-羟基-2-羟甲基-γ-吡喃酮)是由许多曲霉和青霉菌产生的真菌代谢产物。作为一种美白产品,曲酸能够抑制酪氨酸酶的活性,减少黑色素的产生。但是从丝状真菌中提取出的曲酸具有一定毒性。利用SPase对曲酸进行糖基化后,其产物不仅能抑制酪氨酸酶的活性,还有更好的水溶性、稳定性[37]。
植物多酚类物质,如芪类化合物、白藜芦醇、黄酮类化合物,由于其抗菌和抗肿瘤等活性在医药领域有很大的用处。白藜芦醇是天然存在于葡萄、虎杖中的芪类化合物,作为植物抗毒素用于防御伤害和微生物感染[38-39]。近年来的临床试验证明,白藜芦醇可用于治疗糖尿病、心血管疾病和神经系统疾病,并作为食品和化妆品成分用于商业上[40]。然而天然白藜芦醇水溶性较差,生物利用度较低,导致其在工业上应用的效果大大下降[41]。将白藜芦醇糖基化是改善白藜芦醇水溶性或药物特性的一般策略[42],Kraus等对BaSP进行合理地诱变后,得到突变体BaSP Q345F;随后,利用该突变体对白藜芦醇进行高效糖基化,改善了白藜芦醇的水溶性和生物利用度[43]。
目前,已经商业化的产品有α-熊果苷、αGG及曲二糖等。α-熊果苷从2002年起已作为化妆品的美白添加剂在许多品牌中使用(如:日本资生堂、蝶翠诗),其价格约为4000-8000元/kg。商业上将αGG称为格莱可因(Glycoin),由于其生产过程价格昂贵且没有较好的分离方法,导致其价格昂贵--含量50%的αGG价格约为3000元/kg。曲二糖在中国的研究还不多,但已作为试剂及一些药物中间体在日本等国家商业出售[28]。利用SPase生产这些高价值的产品更经济快速,因此该酶具有重要作用及很高的经济价值[1]。
| 产品名称 | 规格 |
| 蔗糖磷酸化酶(SPL-E) | 1ku |
| 产品名称 | 规格 | 纯度 | 2-α-GG content含量 |
| 甘油葡萄糖苷(a-GG) | 1kg | >90% | 40-55% |
[2] YJiang R N, Ye K, Gan T, et al. Application of sucrose phosphorylase in glycosylation. Chinese Journal of Biotechnology, 2021, 37(1): 112-129.
[3] Kiessling LL, Splain RA. Chemical approaches to glycobiology[J]. Annual Review of Biochemistry, 2010, 79: 619-653. DOI:10.1146/annurev.biochem.77.070606.100917
[4] Lindhorst TK. Essentials of carbohydrate chemistry and biochemistry[J]. Carbohydrate Polymers, 2002, 47(1): 87
[5] De Roode BM, Franssen MCR, Van Der Padt A, et al. Perspectives for the industrial enzymatic production of glycosides. Biotechnol Prog, 2003, 19(5): 1391-1402. DOI:10.1021/bp030038q
[6] Lombard V, Ramulu HG, Drula E, et al. The carbohydrate-active enzymes database (CAZy) in 2013. Nucleic Acids Res, 2014, 42(D1): D490-D495. DOI:10.1093/nar/gkt1178
[7] Goedl C, Sawangwan T, Wildberger P, et al. Sucrose phosphorylase: a powerful transglucosylation catalyst for synthesis of α-D-glucosides as industrial fine chemicals. Biocatal Biotransfor, 2010, 28(1): 10-21. DOI:10.3109/10242420903411595
[8] Kagan BO, Latker SN, Zfasman EM. Phosphorolysis of saccharose by cultures of Leuconostoc mesenteroides[J]. Biokhimiya, 1942, 7: 93-108.
[9] Hou GW, Ma JF, Sui SS, Jiang M, Wei P. Research progress on production and application of sucrose phosphorylase[J]. China Brewing, 2010, 29(6): 17-20. (in Chinese)
[10] Russell RR, Mukasa H, Shimamura A, Ferretti JJ. Streptococcus mutans gtfA gene specifies sucrose phosphorylase[J]. Infection and Immunity, 1988, 56(10): 2763-2765. DOI:10.1128/iai.56.10.2763-2765.1988
[11] Desmet T, Soetaert W. Enzymatic glycosyl transfer: mechanisms and applications[J]. Biocatalysis and Biotransformation, 2011, 29(1): 1-18. DOI:10.3109/10242422.2010.548557
[12] Schwarz A, Nidetzky B. Asp-196→Ala mutant of Leuconostoc mesenteroides sucrose phosphorylase exhibits altered stereochemical course and kinetic mechanism of glycosyl transfer to and from phosphate. FEBS Lett, 2006, 580(16): 3905-3910. DOI:10.1016/j.febslet.2006.06.020
[13] Mueller M, Nidetzky B. The role of Asp-295 in the catalytic mechanism of Leuconostoc mesenteroides sucrose phosphorylase probed with site-directed mutagenesis. FEBS Lett, 2007, 581(7): 1403-1408. DOI:10.1016/j.febslet.2007.02.060
[14] Wiesbauer J, Goedl C, Schwarz A, et al. Substitution of the catalytic acid-base Glu237 by Gln suppresses hydrolysis during glucosylation of phenolic acceptors catalyzed by Leuconostoc mesenteroides sucrose phosphorylase. J Mol Catal B: Enzym, 2010, 65(1/4): 24-29.
[15] Wang MM, Wu J, Wu D. Cloning and expression of the sucrose phosphorylase gene in Bacillus subtilis and synthesis of kojibiose using the recombinant enzyme[J]. Microbial Cell Factories, 2018, 17(1): 23. DOI:10.1186/s12934-017-0842-2
[16] Lin JF, Xie L, Guo LQ, Ye ZW. Application of recombinant sucrose phosphatase in preparation of functional oligosaccharide: CN. CN106367458A[P]. 2017-02-01
[17] Zhong C, Duić B, Bolivar JM, Nidetzky B. Three-enzyme phosphorylase cascade immobilized on solid support for biocatalytic synthesis of cello-oligosaccharides[J]. ChemCatChem, 2020, 12(5): 1350-1358. DOI:10.1002/cctc.201901964
[18] Muschiol J, Peters C, Oberleitner N, Mihovilovic MD, Bornscheuer UT, Rudroff F. Cascade catalysis: strategies and challenges en route to preparative synthetic biology[J]. Chemical Communications: Cambridge, England, 2015, 51(27): 5798-5811. DOI:10.1039/C4CC08752F
[19] Li WQ, McArthur JB, Chen X. Strategies for chemoenzymatic synthesis of carbohydrates[J]. Carbohydrate Research, 2019, 472: 86-97. DOI:10.1016/j.carres.2018.11.014
[20] Seo DH, Jung JH, Lee JE, Jeon EJ, Kim W, Park CS. Biotechnological production of arbutins (α- and β-arbutins), skin-lightening agents, and their derivatives[J]. Applied Microbiology and Biotechnology, 2012, 95(6): 1417-1425. DOI:10.1007/s00253-012-4297-4
[21] Jurica K, Gobin I, Kremer D, Čepo DV, Grubešić RJ, Karačonji IB, Kosalec I. Arbutin and its metabolite hydroquinone as the main factors in the antimicrobial effect of strawberry tree (Arbutus unedo L.) leaves[J]. Journal of Herbal Medicine, 2017, 8: 17-23. DOI:10.1016/j.hermed.2017.03.006
[22] Oliveira I, Coelho V, Baltasar R, Pereira JA, Baptista P. Scavenging capacity of strawberry tree (Arbutus unedo L.) leaves on free radicals[J]. Food and Chemical Toxicology, 2009, 47(7): 1507-1511. DOI:10.1016/j.fct.2009.03.042
[23] Avonto C, Wang YH, Avula B, Wang M, Rua D, Khan IA. Comparative studies on the chemical and enzymatic stability of alpha- and beta-arbutin[J]. International Journal of Cosmetic Science, 2016, 38(2): 187-193. DOI:10.1111/ics.12275
[24] Li XY, Xia YY, Shen W, Yang HQ, Cao Y, Chen XZ. Characterization of a sucrose phosphorylase from Leuconostoc mesenterides for the synthesis of α-arbutin[J]. Chinese Journal of Biotechnology, 2020, 36(8): 1546-1555.
[25] Shen Y, LüXQ, Lin L, Li JH, Du GC, Liu L. Semi-rational design of sucrose phosphorylase and optimization of conditions for α-arbutin production[J]. Food and Fermentation Industries, 2020, 46(13): 1-9.
[26] Yu SH, Wang YC, Tian YQ, Xu W, Bai YX, Zhang T, Mu WM. Highly efficient biosynthesis of α-arbutin from hydroquinone by an amylosucrase from Cellulomonas carboniz[J]. Process Biochemistry, 2018, 68: 93-99. DOI:10.1016/j.procbio.2018.02.012
[27] Peng Y, Tang SY, Zhang Y, Zhu L, Ling JY, Hu MR, Tao Y. High-yield production of α-arbutin by an Escherichia coli whole-cell biocatalyst expressing amylosucrase[A]// National Symposium on Enzyme Engineering and Glycobiotechnology[C]. 2015
[28] Seo ES, Kang J, Lee JH, Kim GE, Kim GJ, Kim D. Synthesis and characterization of hydroquinone glucoside using Leuconostoc mesenteroides dextransucrase[J]. Enzyme and Microbial Technology, 2009, 45(5): 355-360. DOI:10.1016/j.enzmictec.2009.07.011
[29] Su GZ, Wang CG, Xue HY, Shi LQ. Sucrose phosphorylase mutant and its application in the production of glycosylglycerol: CN. CN107858335A[P]. 2018-03-30
[30] Takenaka F, Uchiyama H. Synthesis of α-D-glucosylglycerol by α-glucosidase and some of its characteristics[J]. Bioscience, Biotechnology, and Biochemistry, 2000, 64(9): 1821-1826. DOI:10.1271/bbb.64.1821
[31] Goedl C, Sawangwan T, Mueller M, Schwarz A, Nidetzky B. A high-yielding biocatalytic process for the production of 2-O-(alpha-D-glucopyranosyl)-sn-glycerol, a natural osmolyte and useful moisturizing ingredient[J]. Angewandte Chemie: International Ed in English, 2008, 47(52): 10086-10089. DOI:10.1002/anie.200803562
[32] Bolivar JM, Luley-Goedl C, Leitner E, Sawangwan T, Nidetzky B. Production of glucosyl glycerol by immobilized sucrose phosphorylase: options for enzyme fixation on a solid support and application in microscale flow format[J]. Journal of Biotechnology, 2017, 257: 131-138. DOI:10.1016/j.jbiotec.2017.01.019
[33] Duan PF, You JJ, Xu MJ, Yang TW, Shao ML, Zhang X, Rao ZM. Whole-cell biosynthesis of 2-O-α-D-glu- copyranosyl-sn-glycerol by recombinant Bacillus subtilis[J]. Chinese Journal of Biotechnology, 2020, 36(9): 1918-1928.
[34] Sugimoto K, Nomura K, Nishiura H, Ohdan K, Ohdan K, Hayashi H, Kuriki T. Novel transglucosylating reaction of sucrose phosphorylase to carboxylic compounds such as benzoic acid[J]. Journal of Bioscience and Bioengineering, 2007, 104(1): 22-29. DOI:10.1263/jbb.104.22
[35] Li Y, Li Z, He XY, Chen LL, Cheng YC, Jia HH, Yan M, Chen KQ. Characterisation of a Thermobacillus sucrose phosphorylase and its utility in enzymatic synthesis of 2-O-α-D-glucopyranosyl-L-ascorbic acid[J]. Journal of Biotechnology, 2019, 305: 27-34. DOI:10.1016/j.jbiotec.2019.08.018
[36] Gudiminchi RK, Nidetzky B. Walking a fine line with sucrose phosphorylase: efficient single-step biocatalytic production of l-ascorbic acid 2-glucoside from sucrose[J]. Chembiochem, 2017, 18(14): 1387-1390. DOI:10.1002/cbic.201700215
[37] Nakajima N, Ishihara K, Hamada H. Functional glucosylation of kojic acid and daidzein with the Eucalyptus membrane-associated UDP-glucosyltransferase reaction system[J]. Journal of Bioscience and Bioengineering, 2001, 92(5): 469-471. DOI:10.1016/S1389-1723(01)80298-X
[38] Vestergaard M, Ingmer H. Antibacterial and antifungal properties of resveratrol[J]. International Journal of Antimicrobial Agents, 2019, 53(6): 716-723. DOI:10.1016/j.ijantimicag.2019.02.015
[39] Sáez-Sáez J, Wang GK, Marella ER, Sudarsan S, Cernuda Pastor M, Borodina I. Engineering the oleaginous yeast Yarrowia lipolytica for high-level resveratrol production[J]. metabolic Engineering, 2020, 62: 51-61. DOI:10.1016/j.ymben.2020.08.009
[40] Turner RS, Thomas RG, Craft S, Van Dyck CH, Mintzer J, Reynolds BA, Brewer JB, Rissman RA, Raman R, Aisen PS, et al. A randomized, double-blind, placebo-controlled trial of resveratrol for Alzheimer disease[J]. Neurology, 2015, 85(16): 1383-1391. DOI:10.1212/WNL.0000000000002035
[41] Kraus M, Grimm C, Seibel J. Redesign of the active site of sucrose phosphorylase through a clash-induced cascade of loop shifts[J]. Chembiochem, 2016, 17(1): 33-36. DOI:10.1002/cbic.201500514
[42] Gantt RW, Peltier-Pain P, Thorson JS. Enzymatic methods for glycol (diversification/randomization) of drugs and small molecules[J]. Natural Product Reports, 2011, 28(11): 1811-1853. DOI:10.1039/c1np00045d
[43] Kraus M, Grimm C, Seibel J. Reversibility of a point mutation induced domain shift: expanding the conformational space of a sucrose phosphorylase[J]. Scientific Reports, 2018, 8(1): 10490. DOI:10.1038/s41598-018-28802-2

